El investigador Cavendish demostró que el agua era la combinación de dos gases: hidrógeno y oxígeno. Años más tarde, el Francés Lavoisier afirmó rotundamente: la molécula del agua está formada por dos partes de hidrógeno y una de oxígeno, su fórmula es H2O.
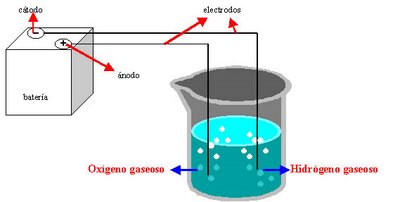
Hace fines del siglo XVII, el agua era considerada un elemento, es decir, una sustancia formada por una sola clase de átomos. Sin embargo, en 1781, el inglés Henry Cavendish demostró que el agua se formaba durante la combustión del hidrógeno. Cavendish afirmaba: si el hidrógeno arde es porque reacciona con el oxígeno del aire formando el agua. Ahora bien, como las propiedades del agua son distintas a las de los gases hidrógeno y oxígeno (ambos elementos), el agua no es una mezcla: es un compuesto (sustancias formadas por distintas clases de átomos). En la actualidad, a través de un proceso llamado hidrólisis es posible demostrar que los elementos constitutivos de agua son el H y O. El procedimiento consiste en descomponer el agua, aplicando corriente eléctrica para obtener hidrógeno y oxígeno gaseoso.
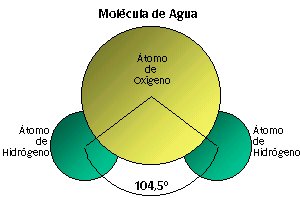
Por otra parte, como sabemos, su fórmula química es H2O, que nos indica que la proporción de hidrógeno y oxígeno en la molécula de agua es 2: 1.
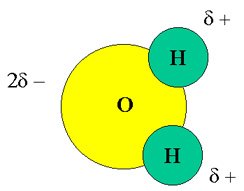
Si comparamos los átomos de H y O, veremos que este último es un átomo de mayor tamaño, y por lo mismo, tiene más electrones o densidad electrónica que el átomo de hidrógeno. Esta característica determina que la molécula de agua sea polar, es decir, sobre el átomo de oxígeno hay una densidad electrónica mayor que genera una carga parcial negativa. Dicho de otro modo En el enlace químico que se forma entre el O y H participan los electrones del nivel más externo de sus átomos, los cuales son atraídos fuertemente hacia el oxígeno debido a su mayor electronegatividad (tendencia de un átomo para atraer electrones) lo que implica una polarización del enlace, es decir, el oxígeno adquiere carga parcial negativa y el hidrógeno carga parcial positiva. Estos enlaces polarizados y la naturaleza angular de la estructura de la molécula de agua dan lugar a un tipo de molécula polar. Esto significa que la molécula de agua tiene carga positiva hacia el extremo donde se encuentran los átomos de hidrógeno y carga negativa hacia el extremo contrario donde se ubica el átomo de oxígeno.
Si comparamos los átomos de H y O, veremos que este último es un átomo de mayor tamaño, y por lo mismo, tiene más electrones o densidad electrónica que el átomo de hidrógeno. Esta característica determina que la molécula de agua sea polar, es decir, sobre el átomo de oxígeno hay una densidad electrónica mayor que genera una carga parcial negativa. Dicho de otro modo En el enlace químico que se forma entre el O y H participan los electrones del nivel más externo de sus átomos, los cuales son atraídos fuertemente hacia el oxígeno debido a su mayor electronegatividad (tendencia de un átomo para atraer electrones) lo que implica una polarización del enlace, es decir, el oxígeno adquiere carga parcial negativa y el hidrógeno carga parcial positiva. Estos enlaces polarizados y la naturaleza angular de la estructura de la molécula de agua dan lugar a un tipo de molécula polar. Esto significa que la molécula de agua tiene carga positiva hacia el extremo donde se encuentran los átomos de hidrógeno y carga negativa hacia el extremo contrario donde se ubica el átomo de oxígeno.
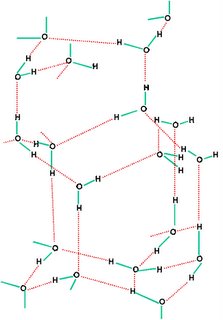
Del mismo modo que existen las uniones interatómicas, hay otras: las uniones intermoleculares, que permiten mantener unidas las moléculas de un compuesto. Dadas las características de polaridad de la molécula de agua, la unión se establece por medio de una fuerza de atracción intermolecular llamada enlace por puente de hidrógeno.
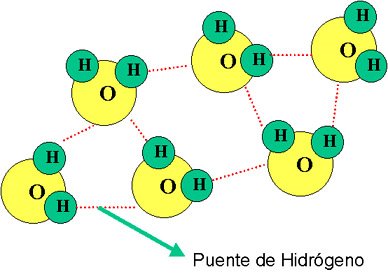
Dicho de otro modo, el extremo positivo de una molécula de agua resulta fuertemente atraído por el extremo negativo de otra molécula de agua cercana de forma que con las moléculas del entorno próximo se forman redes de moléculas unidas entre sí a través de un tipo de enlace especial llamado enlace por puente de hidrógeno.
No hay comentarios:
Publicar un comentario